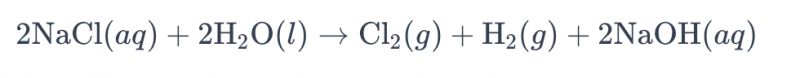Processus electrolyzandi solutionem salsam utens electrodis titanii ad chlorinum producendum vulgo "electrolysis salsae" appellatur. In hoc processu, electroda titanii adhibentur ad reactionem oxidationis ionum chloridi in salsa faciliorem reddendam, quae ad generationem gasii chlorini ducit. Aequatio chemica generalis reactionis est ut sequitur:
In hac aequatione, iones chloridi oxidationem in anodo subeunt, unde gas chlorini producitur, dum moleculae aquae in cathodo reducuntur, unde gas hydrogenii producitur. Praeterea, iones hydroxidi reductionem in anodo subeunt, gas hydrogenii et hydroxidum natrii formantes.
Electio electrodorum titanii ob excellentem resistentiam corrosionis et conductivitatem titanii est, quae ei permittunt stabilem reactionem per electrolysin sine corrosione subire. Hoc facit ut electroda titanii optima sint ad electrolysin salsamenti.
Electrolysis aquae salinae plerumque fontem potentiae externum requirit ad energiam reactioni electrolyticae praebendam. Hic fons potentiae plerumque est fons potentiae currentis continui (DC), quia reactiones electrolyticae directionem constantem fluxus currentis requirunt, et fons potentiae DC directionem currentis constantem praebere potest.
In processu electrolyzationis aquae salinae ad gas chlorinum generandum, fons potentiae DC humilis tensionis vulgo adhibetur. Tensio fontis potentiae a condicionibus specificis reactionis et consilio apparatus pendet, sed plerumque inter 2 et 4 volta variat. Praeterea, intensitas currentis fontis potentiae est parametrus crucialis qui determinandus est secundum magnitudinem camerae reactionis et reditum productionis desideratum.
Summa summarum, electio fontis potentiae ad electrolysim aquae salinae pendet a requisitis specificis experimentorum vel processuum industrialium, ut efficax reactio et consecutio productorum desideratorum confirmentur.
Tempus publicationis: XVI Ianuarii MMXXIV